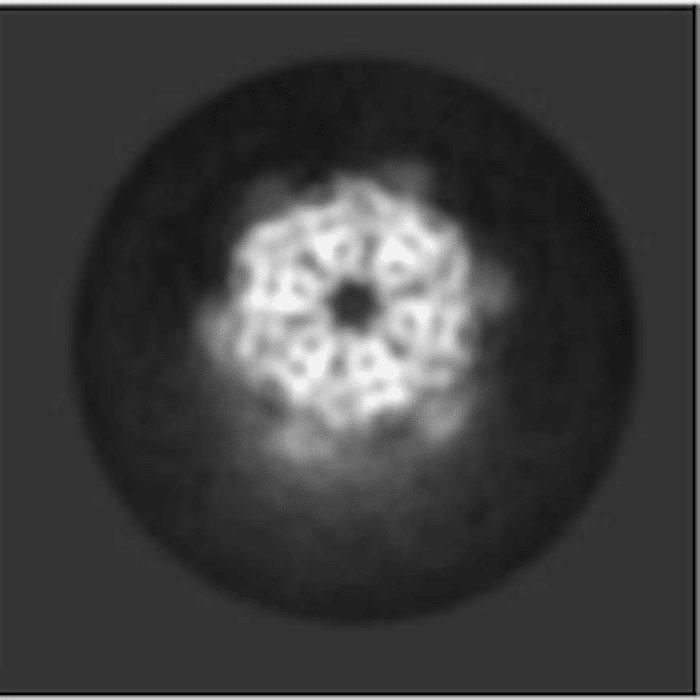
Un equipo del Centro Nacional de Investigaciones Oncológicas (CNIO) ha determinado por primera vez la estructura de alta resolución de un complejo de proteínas (R2TP) involucrado en procesos clave para la supervivencia celular y en enfermedades como el cáncer. Este logro ha sido posible gracias al uso de criomicroscopía electrónica de alta resolución, una técnica presentada al CNIO gracias a Óscar Llorca, director del Programa de Biología Estructural y autor principal del estudio publicado en Nature Communications.
En 2017, el Premio Nobel de Química fue otorgado a tres científicos (Jacques Dubochet, Joachim Frank y Richard Henderson) por su trabajo en el desarrollo de la criomicroscopía electrónica. Esta técnica permite obtener imágenes de moléculas, determinar su estructura y los procesos biológicos en detalle atómico.
Óscar Llorca y su equipo han utilizado esta técnica para aprender sobre la estructura y el funcionamiento de un sistema complejo llamado R2TP, que está involucrado en varios procesos clave para la supervivencia celularcomo por ejemplo la activación de las quinasas mTOR, ATR o ATM, proteínas que son actualmente el foco de diversos fármacos en desarrollo contra el cáncer.
«Si entendemos esta vía – explica Llorca en un comunicado – podremos identificar nuevas formas de focalizar la actividad de estas enzimas. Gracias a la microscopía crioelectrónica, hemos podido visualizar, por primera vez, la estructura del sistema humano R2TP en alta resolución”.
Lo que más sorprendió a los investigadores fue la complejidad inesperada del sistema R2TP humano, en comparación con sus homólogos de levadura.
“Esta primera observación del sistema R2TP humano – concluye Llorca – nos ha permitido empezar a comprender su estructura y mecanismos de funcionamiento, hasta ahora desconocidos. Nuestros siguientes pasos son estudiar los detalles de cómo R2TP y HSP90 consiguen ensamblar los complejos formados por mTOR y otras quinasas de la familia y, así, encontrar formas de interferir sobre estos procesos
Juan Scaliter