De acuerdo con la Organización Mundial de la Salud (OMS) cada año se infectan de malaria unas 210 millones de personas y muere medio millón. El 92 % de ellas en la región del África subsahariana.
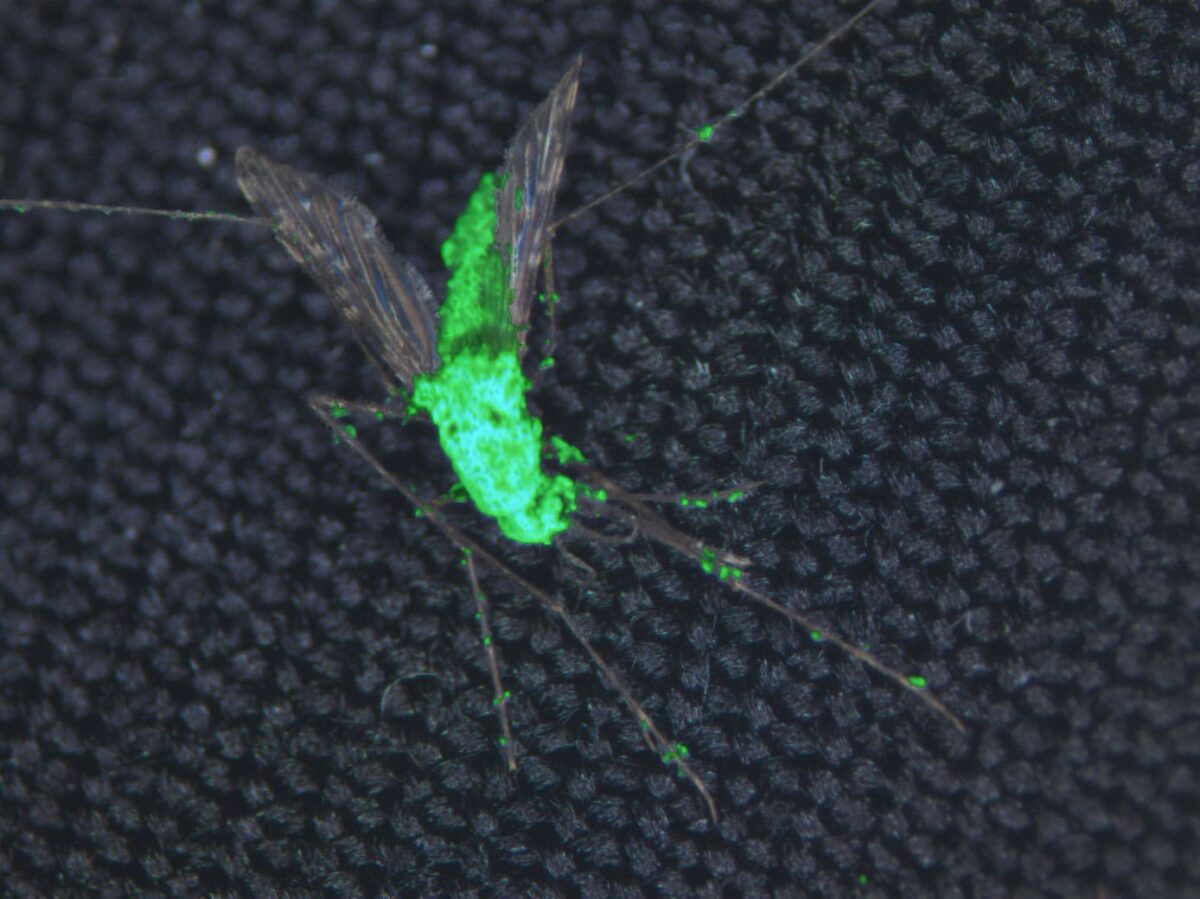
Para intentar reducir el impacto de esta enfermedad, un grupo de científicos de la Universidad de Maryland han modificado genéticamente al hongo Metarhizium pingshaensei, un “pesticida natural de mosquitos”,para producir veneno de araña y escorpión. El hongo no representa ningún riesgo para los humanos.
Hay evidencias previas de que este hongo es específico de las especies de mosquitos portadores de la malaria, incluyendo Anopheles gambiae y Aedes aegypti. Cuando las esporas del hongo entran en contacto con el cuerpo del insecto, las esporas germinan y penetran en su exoesqueleto, comiéndolo desde el interior. Por sí solo, sin embargo, el hongo requiere dosis bastante altas de esporas y una gran cantidad de tiempo para tener efectos letales. Para aumentar sus efectos, los investigadores lo modificaron con varios genes que expresan las neurotoxinas del veneno de la araña y el escorpión, tanto solos como en combinación con otras toxinas.
Brian Lovett, coautor del estudio publicado en Scientific Reports, señala que “las cepas de hongos son capaces de prevenir la transmisión de la enfermedad en más del 90% de los mosquitos después de sólo cinco días”.
Los investigadores probaron entonces las cepas de hongos manipuladas en mosquitos resistentes a los insecticidas, capturados en Burkina Faso. Cada nueva cepa mató mosquitos más rápida y eficientemente que el hongo no alterado. Sin embargo, la cepa más efectiva fue la que llevaba una combinación de dos toxinas, una derivada del escorpión de cola gorda o Androctonus australis (cuyo hábitat es el norte de África) y otra de la araña Hadronyche versuta, endémica de Australia. Ambas toxinas ya han sido aprobadas por la Agencia de Protección Ambiental de los Estados Unidos parasu uso como insecticida.
En cuanto a la seguridad de este experimento, los expertos incluyeron en la modificación del hongo una secuencia promotora altamente específica, en pocas palabras un “interruptor genético” que asegura que los genes de la toxina sólo pueden activarse en la sangre de estos insectos. Como resultado, el hongo no liberará la toxina en el medio ambiente.
Para garantizar aún más la seguridad de otras especies de insectos, las cepas se probaron en abejas, tanto rociándolas con las esporas como exponiéndolas a a tejidos que las contenían. Después de dos semanas, ninguna abeja había muerto como resultado del hongo potenciado con toxina. El próximo paso es asegurarse que el hongo no afectará a ningún otro insecto y luego evaluar su eficacia en poblaciones silvestres.
Juan Scaliter