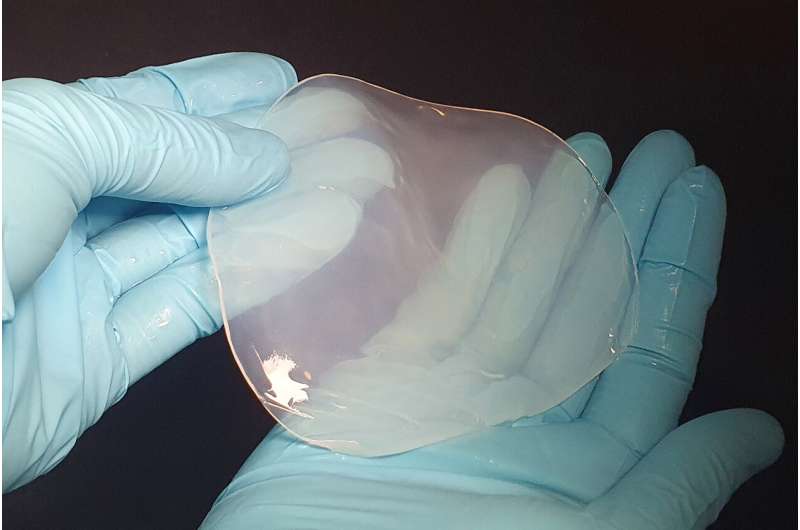
La K. sucrofermentans produce de forma natural celulosa de gran pureza, un material muy demandado para aplicaciones biomédicas
Las bacterias producen materiales de interés para el ser humano, como celulosa, seda y minerales. La ventaja de producir bacterias de esta manera es que es sostenible, tiene lugar a temperatura ambiente y en agua. La desventaja es que el proceso lleva tiempo y da lugar a cantidades demasiado pequeñas para ser de utilidad industrial.
Por eso, los investigadores llevan tiempo intentando convertir los microorganismos en minifábricas vivas capaces de producir más rápidamente cantidades mayores del producto deseado. Para ello es necesario intervenir en el genoma o cultivar las cepas bacterianas más adecuadas.
El grupo de investigación dirigido por André Studart, catedrático de Materiales Complejos de la ETH de Zúrich, presenta ahora un nuevo enfoque a partir de la bacteria productora de celulosa Komagataeibacter sucrofermentans. Siguiendo los principios de la evolución por selección natural, el nuevo método permite a los científicos producir decenas de miles de variantes de la bacteria con gran rapidez y seleccionar las cepas que producen más celulosa.
La K. sucrofermentans produce de forma natural celulosa de gran pureza, un material muy demandado para aplicaciones biomédicas y la producción de material de envasado y textiles. Dos propiedades de este tipo de celulosa son que favorece la cicatrización de heridas y previene las infecciones. «Sin embargo, las bacterias crecen lentamente y producen cantidades limitadas de celulosa. Por tanto, teníamos que encontrar la forma de aumentar la producción», explica Julie Laurent, estudiante de doctorado del grupo de Studart y primera autora de un estudio que acaba de publicarse en la revista científica PNAS.
El método que ha desarrollado ha logrado producir un pequeño número de variantes de Komagataeibacter que generan hasta un setenta por ciento más de celulosa que en su forma original.
Acelerar la evolución con luz ultravioleta
La investigadora de materiales primero tuvo que crear nuevas variantes de la bacteria original que se da en la naturaleza, conocida como tipo salvaje. Para ello, Julie Laurent irradió las células bacterianas con luz UV-C, que daña puntos aleatorios del ADN bacteriano. A continuación, colocó las bacterias en una habitación oscura para impedir la reparación de los daños en el ADN e inducir mutaciones.
Con un aparato en miniatura, encapsuló cada célula bacteriana en una gotita de solución nutritiva y dejó que las células produjeran celulosa durante un tiempo determinado. Tras el periodo de incubación, utilizó un microscopio de fluorescencia para analizar cuáles de las células habían producido mucha celulosa y cuáles ninguna o muy poca.
Mediante un sistema de clasificación desarrollado por el grupo del químico de la ETH Andrew De Mello, el equipo de Studart separó automáticamente las células que habían evolucionado hasta producir una cantidad excepcionalmente grande de celulosa. Este sistema de clasificación está totalmente automatizado y es muy rápido. En cuestión de minutos, puede escanear medio millón de gotas con un láser y seleccionar las que contienen más celulosa. Sólo quedaban cuatro que producían entre un 50 y un 70 por ciento más de celulosa que el tipo salvaje.
Las células evolucionadas de K. sucrofermentans pueden crecer y producir celulosa en esteras en viales de cristal en la interfase entre el aire y el agua. Una estera de este tipo pesa naturalmente entre dos y tres miligramos y tiene un grosor de 1,5 milímetros. Las esteras de celulosa de las nuevas variantes evolucionadas son casi el doble de pesadas y gruesas que las del tipo silvestre.
Julie Laurent y sus colegas también analizaron genéticamente estas cuatro variantes para averiguar qué genes habían sido alterados por la luz UV-C y cómo estos cambios habían conducido a la sobreproducción de celulosa. Las cuatro variantes tenían la misma mutación en el mismo gen. Este gen es el modelo de una enzima que degrada proteínas, una proteasa. Sin embargo, para sorpresa del investigador de materiales, los genes que controlan directamente la producción de celulosa no habían cambiado. «Sospechamos que esta proteasa degrada proteínas que regulan la producción de celulosa. Sin esta regulación, la célula ya no puede detener el proceso», explica el investigador.
El nuevo enfoque es versátil y puede aplicarse a bacterias que producen otros materiales. Estos métodos se desarrollaron originalmente para crear bacterias productoras de determinadas proteínas o enzimas. «Somos los primeros en utilizar este método para mejorar la producción de materiales no proteicos», afirma André Studart, catedrático de la ETH. «Para mí, este trabajo es un hito».
Los investigadores han solicitado una patente para el método y las variantes bacterianas mutadas. En un siguiente paso, les gustaría colaborar con empresas productoras de celulosa bacteriana para probar el nuevo microorganismo en condiciones industriales reales.
REFERENCIA