La Asamblea Nobel del Instituto Karolinska ha decidido hoy conceder el Premio Nobel de Fisiología o Medicina 2023 conjuntamente a Katalin Karikó y Drew Weissman por sus descubrimientos sobreque permitieron desarrollar vacunas eficaces de ARNm contra el COVID-19
Los descubrimientos de los dos Premios Nobel fueron fundamentales para desarrollar vacunas eficaces de ARNm contra el COVID-19 durante la pandemia que comenzó a principios de 2020. Gracias a sus revolucionarios descubrimientos, que han cambiado radicalmente nuestra comprensión de cómo interactúa el ARNm con nuestro sistema inmunitario, los galardonados contribuyeron a un ritmo sin precedentes en el desarrollo de vacunas durante una de las mayores amenazas para la salud humana de los tiempos modernos.
Las vacunas antes de la pandemia
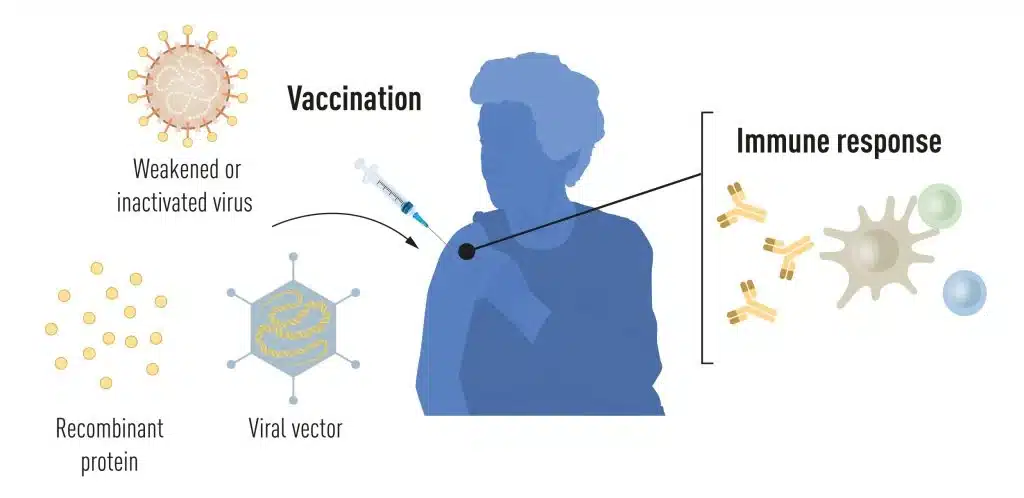
Métodos de producción de vacunas antes de la pandemia COVID-19 Métodos de producción de vacunas antes de la pandemia COVID-19. © Comité Nobel de Fisiología o Medicina. Ilustración. Mattias Karlén
La vacunación estimula la formación de una respuesta inmunitaria frente a un patógeno concreto. Esto da al organismo una ventaja en la lucha contra la enfermedad en caso de una exposición posterior. Desde hace tiempo existen vacunas basadas en virus muertos o debilitados, como las vacunas contra la poliomielitis, el sarampión y la fiebre amarilla. En 1951, Max Theiler recibió el Premio Nobel de Fisiología o Medicina por desarrollar la vacuna contra la fiebre amarilla.
Gracias a los avances de la biología molecular en las últimas décadas, se han desarrollado vacunas basadas en componentes virales individuales, en lugar de virus enteros. Partes del código genético viral, que suelen codificar proteínas que se encuentran en la superficie del virus, se utilizan para fabricar proteínas que estimulan la formación de anticuerpos bloqueadores del virus. Ejemplos de ello son las vacunas contra el virus de la hepatitis B y el virus del papiloma humano. Otra posibilidad es trasladar partes del código genético viral a un virus portador inofensivo, un «vector». Este método se utiliza en las vacunas contra el virus del Ébola. Cuando se inyectan vacunas vectoriales, la proteína viral seleccionada se produce en nuestras células, estimulando una respuesta inmunitaria contra el virus objetivo.
La producción de vacunas basadas en virus completos, proteínas y vectores requiere cultivos celulares a gran escala. Este proceso, que requiere muchos recursos, limita las posibilidades de producción rápida de vacunas en respuesta a brotes y pandemias. Por ello, los investigadores llevan mucho tiempo intentando desarrollar tecnologías de vacunas independientes del cultivo celular, pero esto ha resultado todo un reto.
Vacunas de ARNm: Una idea prometedora
En nuestras células, la información genética codificada en el ADN se transfiere al ARN mensajero (ARNm), que se utiliza como molde para la producción de proteínas. En la década de 1980 se introdujeron métodos eficaces de producción de ARNm sin cultivo celular, la llamada transcripción in vitro. Este paso decisivo aceleró el desarrollo de las aplicaciones de la biología molecular en varios campos. También despegaron las ideas de utilizar las tecnologías de ARNm para vacunas y fines terapéuticos, pero aún quedaban obstáculos por superar. El ARNm transcrito in vitro se consideraba inestable y difícil de administrar, lo que exigía el desarrollo de sofisticados sistemas lipídicos portadores para encapsular el ARNm. Además, el ARNm producido in vitro provocaba reacciones inflamatorias. Por tanto, el entusiasmo por desarrollar la tecnología del ARNm con fines clínicos fue inicialmente limitado.
Estos obstáculos no desanimaron a la bioquímica húngara Katalin Karikó, que se dedicó a desarrollar métodos para utilizar el ARNm con fines terapéuticos. A principios de la década de 1990, cuando era profesora adjunta en la Universidad de Pensilvania, se mantuvo fiel a su visión de utilizar el ARNm con fines terapéuticos a pesar de las dificultades para convencer a los financiadores de la importancia de su proyecto. Un nuevo colega de Karikó en su universidad era el inmunólogo Drew Weissman. Estaba interesado en las células dendríticas, que tienen importantes funciones en la vigilancia inmunitaria y la activación de respuestas inmunitarias inducidas por vacunas. Espoleados por las nuevas ideas, pronto comenzó una fructífera colaboración entre ambos, centrada en cómo los distintos tipos de ARN interactúan con el sistema inmunitario.
El descubrimiento
Karikó y Weissman observaron que las células dendríticas reconocen el ARNm transcrito in vitro como una sustancia extraña, lo que provoca su activación y la liberación de moléculas de señalización inflamatoria. Se preguntaron por qué el ARNm transcrito in vitro era reconocido como extraño mientras que el ARNm procedente de células de mamífero no daba lugar a la misma reacción. Karikó y Weissman se dieron cuenta de que algunas propiedades críticas debían distinguir los distintos tipos de ARNm.
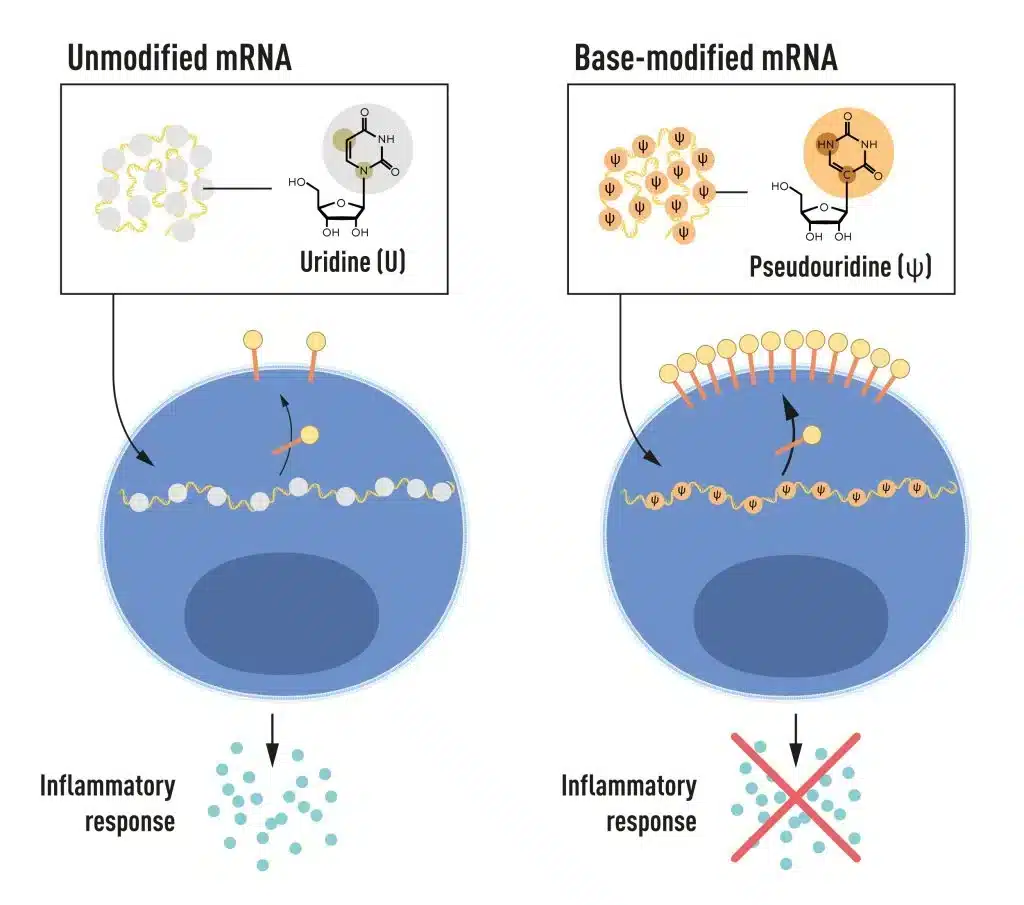
El ARNm contiene cuatro bases diferentes, abreviadas A, U, G y C. Los Premios Nobel descubrieron que el ARNm con bases modificadas puede utilizarse para bloquear la activación de reacciones inflamatorias (secreción de moléculas de señalización) y aumentar la producción de proteínas cuando el ARNm se administra a las células. © Comité Nobel de Fisiología o Medicina. Ill. Mattias Karlén
El ARN contiene cuatro bases, abreviadas A, U, G y C, que corresponden a A, T, G y C en el ADN, las letras del código genético. Karikó y Weissman sabían que las bases del ARN de células de mamíferos suelen estar químicamente modificadas, mientras que el ARNm transcrito in vitro no lo está. Se preguntaron si la ausencia de bases alteradas en el ARN transcrito in vitro podría explicar la reacción inflamatoria no deseada. Para investigarlo, produjeron distintas variantes de ARNm, cada una con alteraciones químicas únicas en sus bases, que administraron a células dendríticas.
Los resultados fueron sorprendentes: La respuesta inflamatoria casi desaparecía cuando se incluían modificaciones en las bases del ARNm. Esto supuso un cambio de paradigma en nuestra comprensión de cómo las células reconocen y responden a diferentes formas de ARNm. Karikó y Weissman comprendieron inmediatamente que su descubrimiento tenía un profundo significado para el uso del ARNm como terapia. Estos resultados fundamentales se publicaron en 2005, quince años antes de la pandemia de COVID-19.
En otros estudios publicados en 2008 y 2010, Karikó y Weissman demostraron que la administración de ARNm generado con modificaciones en las bases aumentaba notablemente la producción de proteínas en comparación con el ARNm no modificado. El efecto se debía a la menor activación de una enzima que regula la producción de proteínas. Con sus descubrimientos de que las modificaciones de las bases reducían las respuestas inflamatorias y aumentaban la producción de proteínas, Karikó y Weissman habían eliminado obstáculos críticos en el camino hacia las aplicaciones clínicas del ARNm.
Las vacunas de ARNm hicieron realidad su potencial
El interés por la tecnología del ARNm empezó a repuntar y, en 2010, varias empresas trabajaban en el desarrollo del método. Se buscaban vacunas contra el virus del Zika y el MERS-CoV; este último está estrechamente relacionado con el SARS-CoV-2. Tras el brote de la pandemia de COVID-19, se desarrollaron a una velocidad récord dos vacunas de ARNm modificado con bases que codificaban la proteína de superficie del SARS-CoV-2. Se registraron efectos protectores de alrededor del 95%. Se notificaron efectos protectores de alrededor del 95%, y ambas vacunas fueron aprobadas ya en diciembre de 2020.
La impresionante flexibilidad y rapidez con que pueden desarrollarse las vacunas de ARNm allanan el camino para utilizar la nueva plataforma también para vacunas contra otras enfermedades infecciosas. En el futuro, la tecnología también podrá utilizarse para administrar proteínas terapéuticas y tratar algunos tipos de cáncer.
También se introdujeron rápidamente otras vacunas contra el SRAS-CoV-2, basadas en diferentes metodologías, y en conjunto se han administrado más de 13.000 millones de dosis de la vacuna COVID-19 en todo el mundo. Las vacunas han salvado millones de vidas y evitado enfermedades graves en muchas más, permitiendo que las sociedades se abran y vuelvan a la normalidad. A través de sus descubrimientos fundamentales sobre la importancia de las modificaciones de las bases en el ARNm, los galardonados con el Nobel de este año contribuyeron de forma decisiva a este desarrollo transformador durante una de las mayores crisis sanitarias de nuestro tiempo.
REFERENCIAS
Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation



