Dicen que Hong Kong, Río de Janeiro, Taipei o Beijing están entre los mejores del mundo en el arte de la pirotecnia lúdica. Aquí en España podemos presumir de los espectáculos que ofrecen en Elche, Cataluña, Murcia o la Comunidad Valenciana. En cualquiera de los casos, los fuegos artificiales son pura química. Y este 4 de julio serán la traca principal de las celebraciones del Día de la Independencia en Estados Unidos.
Su origen, directamente relacionado con la invención de la pólvora, se remonta a hace más de 1000 años en China (según las memorias de Alfonso XI de Castilla). Después, los árabes llevaron la fórmula de este material inflamable a Europa durante su expansión por España y el Norte de África. Por desgracia, como podéis imaginar, no lo hicieron precisamente con fuegos artificiales y con intenciones lúdicas, sino con armas, otra de las aplicaciones de la pirotecnia (menos divertida).
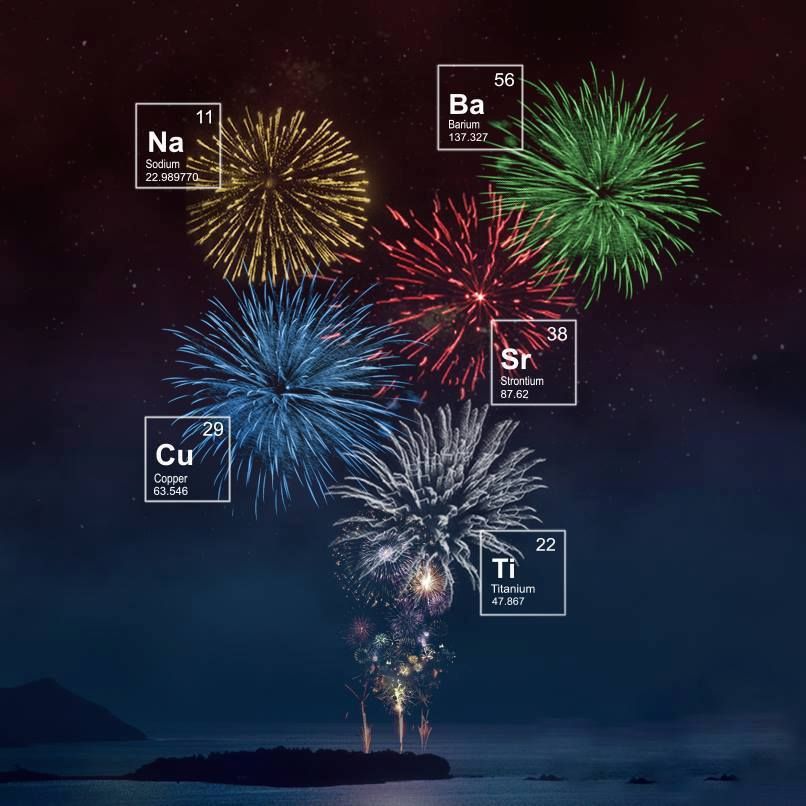
A continuación, os mostramos la «magia» encerrada en estos productos explosivos.
¿Cómo se consiguen los colores?
El sodio es el responsable de los amarillos y los dorados.
El bario produce los verdes.
El cobre (carbonato de cobre / monocloruro de cobre) da lugar al color azul.
Las sales de estroncio dan el color rojo.
El titanio es el responsable de los destellos blancos y plateados.
Otros químicos usados habitualmente son:
El carbono, que provee el combustible.
Los oxidantes, que producen el oxígeno para la combustión.
El magnesio, que incrementa el brillo y la luminosidad.
El antimonio, que da un efecto glitter (es un efecto que marca los halos de los brillos).
El calcio, que da más intensidad a los colores. Foto: Creative Commons
¿Cómo se produce el color?
Detrás de esas bellas explosiones de color en el aire básicamente se encuentran dos fenómenos: incandescencia y luminiscencia.
Foto: Creative Commons (por JavierPsilocybin / Flickr)
La incandescencia o candoluminiscencia
En la incandescencia, la luz se produce a consecuencia de la energía calorífica. Si calentamos un cuerpo a una determinada temperatura, este emite una radiación electromagnética dentro del espectro visible.
El secreto está en la temperatura. Dependiendo de esto, la luz puede variar desde el blanco hasta el rojo haciendo una paradita en los colores intermedios. Al controlar esta temperatura, podemos dominar el color deseado.
Foto: Creative Commons
La luminiscencia, también conocida como ‘luz fría’ es cualquier proceso de emisión de luz que no necesite de altas temperaturas para producirse, sino que puede darse a temperatura ambiente e incluso más bajas.
Cuando un sólido recibe energía, sus electrones se cargan y se excitan, saltando como locos a un nivel de energía superior.
Como sabéis, los átomos excitados son muy inestables, por ello los electrones se ven en la responsabilidad de volver a su estado fundamental, intentando absorber la energía en forma de fotones.
El color de la luz emitida variará depediendo de la longitud de onda de la energía.
Foto: Creative Commons
¿Por qué tienen diferentes formas?
Sus asombrosas formas y las direcciones que toman se deben a una mera cuestión de diseño de los cartuchos y de cómo se organiza en su interior la pólvora y el resto de sustancias.
Cuando la mecha alcanza la pólvora del cartucho, estallan los metales oxidantes hacia fuera creando los fuegos artificiales.
Después, para que este llegue al cielo, son necesarios unos tubos propulsores conocidos como morteros.
Foto: Creative Commons
¿Cuál es el tipo de pólvora más común?
La más utilizada es la pólvora negra. La más popular está compuesta de un 75% de nitrato de potasio, un 15% de carbono y 10% de azufre (masa/masa).
El carbono y el azufre arden gracias al nitrato potásico, que suministra el oxígeno para que se produzca la combustión.
En el caso de la pirotecnia, la receta explosiva se cambia un poco. Se sustituye el nitrato por clorato de potasio, ya que su combustión junto al azufre y el carbón se produce de forma más rápida.
Una vez tenemos la sustancia oxidante y la sustancia reductora nos falta un tercer elemento clave para los fuegos artificiales: sales o sustancias metálicas que son responsables del color (como las que vimos en la anterior fotografía).
Foto: Creative Commons